2021��6��23-26�����һ��һ�ȵ�ȫ����K�W(xu��)ʢ��(hu��)������(gu��)�H���K���(hu��)��ILC 2021���Ծ�����ʽ���_(k��i)���ڴ˴δ��(hu��)���������(l��i)�����ִ�W(xu��)��һ�t(y��)Ժ����������ڈF(tu��n)�(du��)���A��ʿ��(du��)һ�(xi��ng)�u(p��ng)�r(ji��)�W�ײ��fƬ(li��n)���}���_(d��)�����fƬ�ί����Ա����׳��˻��ߵį�Ч�Ͱ�ȫ�Ե��_(k��i)�����������������III���R���о��Y(ji��)���M(j��n)���˽�B����˴ι�����III���R���о��Y(ji��)����������W�ײ��fƬ�ڷ����������Ա��������еđ�(y��ng)���ṩ�����C��(j��)�������

�W�ײ��fƬ�����������͘�(l��)���fƬ�����SH229Ƭ�������Ͼ�ʥ��ˎ�I(y��)�ɷ�����˾�����аl(f��)�ć�(gu��)��(n��i)�ׂ�(g��)HCV NS5B�ۺ�ø���Ƅ��������Ҳ��ȫ����(n��i)�����ײ��f��ڶ���(g��)���III���R���о����ύ������Ո(q��ng)��HCV NS5B���Ƅ����������һ������(l��i)ǰ�wˎ���������W�ײ��f��ͨ�^(gu��)���K���x�����D(zhu��n)������п��������Եķ���Ȼ����������������ԓ����Ȼ��������������c���β�����(f��)�������NS5B�ۺ�ø�l(f��)����(j��ng)��(zh��ng)�ԽY(ji��)�ϣ����ٰ����ɲ�����(f��)�ƕr(sh��)��Ҫ����Ȼ���������ᓽ�뵽HCV RNA�������γ��e(cu��)�`�IJ���RNAģ�壬��(d��o)�²���RNA朵����L(zh��ng)��ǰ�Kֹ�������β����ď�(f��)��Ҳ��˱��Kֹ������R��ǰ�о��Y(ji��)�������������w���(f��)���ӻ�HCVccϵ�y(t��ng)�У��W�ײ��f��(du��)��������HCV�����ƻ�������(y��u)�����ײ��f��������?ji��n)W�ײ��f�cNS5A���Ƅ��}���_(d��)�����f�pˎ(li��n)�Ϻ�ʬF(xi��n)�ж����߶ȵąf(xi��)ͬ���á�

�����������R���о���һ�(xi��ng)�_(k��i)����������������III���R���о������ּ���_�C�W�ײ��fƬ(li��n)���}���_(d��)�����fƬ�ί�12�܌�(du��)����1��2����3��6�����Ա����׳��˻��ߵį�Ч�Ͱ�ȫ�����ԇ�(y��n)���ÆνMĿ��(bi��o)ֵ���O(sh��)Ӌ(j��)��������ԇ�߾����ܞ���12�ܵĊW�ײ��fƬ600 mg QD(li��n)���}���_(d��)�����fƬ60 mg QD�ί���������ί�����ԇ�����ί��Y(ji��)�����4�ܺ͵�12�ܽ����S�L��������ί��Y(ji��)�����12���S�L�r(sh��)HCV RNA < LLOQ����ԇ��������ί��Y(ji��)�����24���M(j��n)���~���S�L������о�����Ҫ��Ч�ԽK�c(di��n)��SVR12����������Ҫ��Ч�ԽK�c(di��n)����SVR4�����SVR24�ʵȡ�
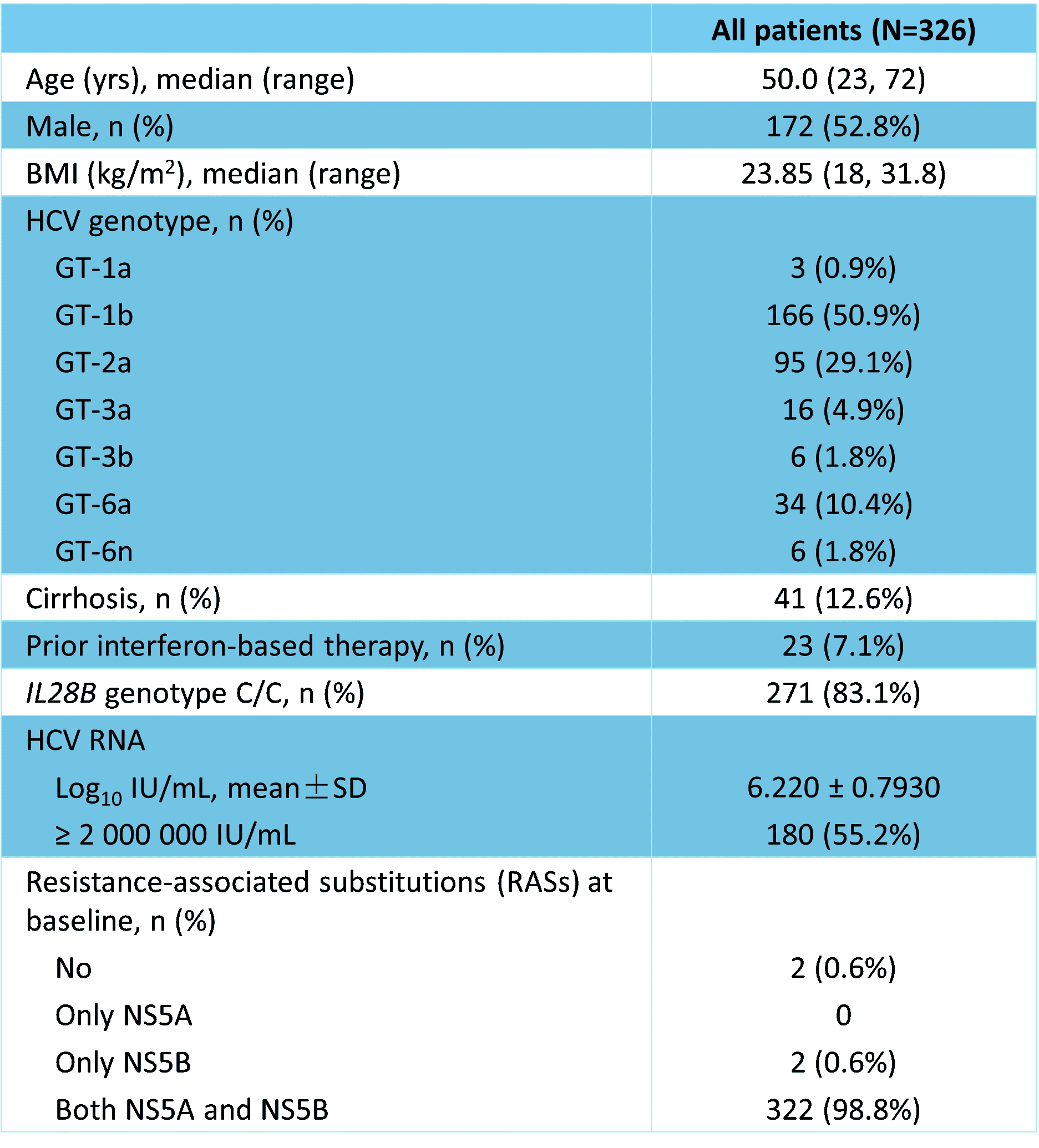
���о���326����ԇ�߽�����ԇ�(y��n)ˎ��oˎ�������GT-1a 3����0.9%����GT-1b 166����50.9%������GT-2a 95����29.1%������GT-3a 16����4.9%����GT-3b 6����1.8%���������GT-6a 34����10.4%������GT-6n 6����1.8%���������������ԇ�������������41����12.6%���ϲ��д����Ը�Ӳ����23����7.1%�����������^(gu��)�ɔ_�ط����ί�������99.4%����ԇ�ߴ���NS5A��/��NS5B���P(gu��n)λ�c(di��n)������ˎͻ׃������������ԇ�ߵ�HCV RNAƽ������ˮƽ����6 Log10 IU/mL��
ԇ�(y��n)�Y(ji��)���@ʾ��������ί��Y(ji��)�����12�ܕr(sh��)������321����ԇ�߫@���˳��m(x��)�����W(xu��)��(y��ng)�����SVR12�ʼ�95%���Ņ^(q��)�g��98.5%��96.5%,99.5%������Ч�@����(y��u)�ښvʷ��(du��)��88%��P<0.0001����������ګ@��SVR12��321����ԇ���У���1����ԇ�����ί��Y(ji��)����24��ʧ�L��������������ԇ�����ί��Y(ji��)����24�����^�m(x��)�@���˳��m(x��)�����W(xu��)��(y��ng)����
���M�����Y(ji��)���@ʾ��������W�ײ��f(li��n)���}���_(d��)�����f���ί������ڲ�ͬ��������HCV�����о����F(xi��n)�����õ��ί�Ч��������������GT-1a��GT-2a�����GT-3b�����е�SVR12�ʾ��_(d��)����100%������GT-1b������GT-3a����GT-6��������SVR12��Ҳ�քe�_(d��)����98.8%������93.8%��95%�����eֵ��ע��������������(du��)��Ŀǰ���y�ε�GT-3�������e��GT3b����������W�ײ��f(li��n)���}���_(d��)�����f���ί��������F(xi��n)���˸��ߵij��m(x��)�����W(xu��)��(y��ng)���ʡ���������c�F(xi��n)���ί��ֶ����������W�ײ��f�c�}���_(d��)�����f��(li��n)���ί��������и���(y��u)����ί�Ч�������

�ڰ�ȫ�����棬���о����gδ�l(f��)����ԇ�������¼���������H�l(f��)��1����(d��o)����ԇ����ǰ�˳��IJ����¼����������ί�����F(xi��n)�������¼���TEAE���������^�����(sh��)���p�Ȼ��жȣ��H��14����4.3%����ԇ�߰l(f��)����3��(j��)�����ϵ���(sh��)�(y��n)���z�鮐���������������������������Ѫ�������ἤø��������Ѫ�}��������Ѫ⛽�������ѪС��Ӌ(j��)��(sh��)����������ԇ�(y��n)��δ���F(xi��n)�κ�3��(j��)�����ϵĸι�����ALT���AST��đ�t�أ�������r������ԓ�о��Y(ji��)���������W�ײ��f(li��n)���}���_(d��)�����f���ί����������^������ȫ�������
��֮�������˴��W�ײ��fIII���R���о���(sh��)��(j��)�����������҇�(gu��)�������ί��I(l��ng)����ش�ͻ����������Ї�(gu��)ԭ��(chu��ng)����DAAˎ���������������Ա������ί��I(l��ng)���ṩ�������C��(j��)�����Ķ��o�҇�(gu��)�����Ա��λ����ṩ������(y��u)���ί��x������
�P(gu��n)��ʥ��ˎ�I(y��)
ʥ��ˎ�I(y��)������1996�������һ�Ҽ���ˎ�аl(f��)���ˎƷ���a(ch��n)�������W(xu��)�g(sh��)�ƏV��һ�w�ć�(gu��)�����c(di��n)���¼��g(sh��)��I(y��)����˾����ˎ�аl(f��)�������L(zh��ng)�ڈ�(ji��n)��(sh��)ʩ�a(ch��n)Ʒ�аl(f��)��(chu��ng)��(zh��n)�������������аl(f��)���w���B(t��i)ϵ�y(t��ng)���O(sh��)����(sh��)�F(xi��n)�������|(zh��)�l(f��)�F(xi��n)�����������Y�x�������A(ch��)�R���A(y��)��(sh��)�(y��n)���ƥ�����������ڳɞ鿹�[��������Ⱦϵ�y(t��ng)�����I(l��ng)����I(l��ng)����������ʥ��ˎ�I(y��)�F(xi��n)����һ�l����30����(g��)������ˎƷ�N�Įa(ch��n)Ʒ�ܾ����������7��(g��)������ˎ�����M(j��n)���R��ԇ�(y��n)�����δ��(l��i)��ʥ��ˎ�I(y��)�����m(x��)����ռ�N(xi��o)������20%���аl(f��)Ͷ������������������ڝM�㻼�ߵ��R����������������������������
��ע��ʥ�Z��?Sanoldi?�W�ײ��fƬ �l(f��)����(zhu��n)�� ��(zhu��n)��̖(h��o) ZL201410081865.5��